- 2011-12-02 11:19
- 作者:佚名
- 来源:中国政府网
为进一步加强医疗器械注册管理,严格规范第二类医疗器械注册申报资料要求,在总结各地实践经验的基础上,国家食品药品监督管理局组织制定了《豁免提交临床试验资料的第二类医疗器械目录(试行)》,并于日前印发,就相关事宜明确如下:
医疗器械生产企业在申报本目录范围内产品注册时,可以书面申请免于提交临床试验资料,但应同时提交申报产品与已上市同类产品的对比说明。根据《医疗器械注册管理办法》附件12规定,虽未列入本目录,但执行国家标准、行业标准的检验、诊断类第二类医疗器械,申报产品注册时,不需要提供临床试验资料。
该《目录》自发布之日起实施。地方各级食品药品监管部门要严格管理,不得擅自扩大目录范围。本目录发布前已受理的注册申报项目,按原规定继续审评、审批。
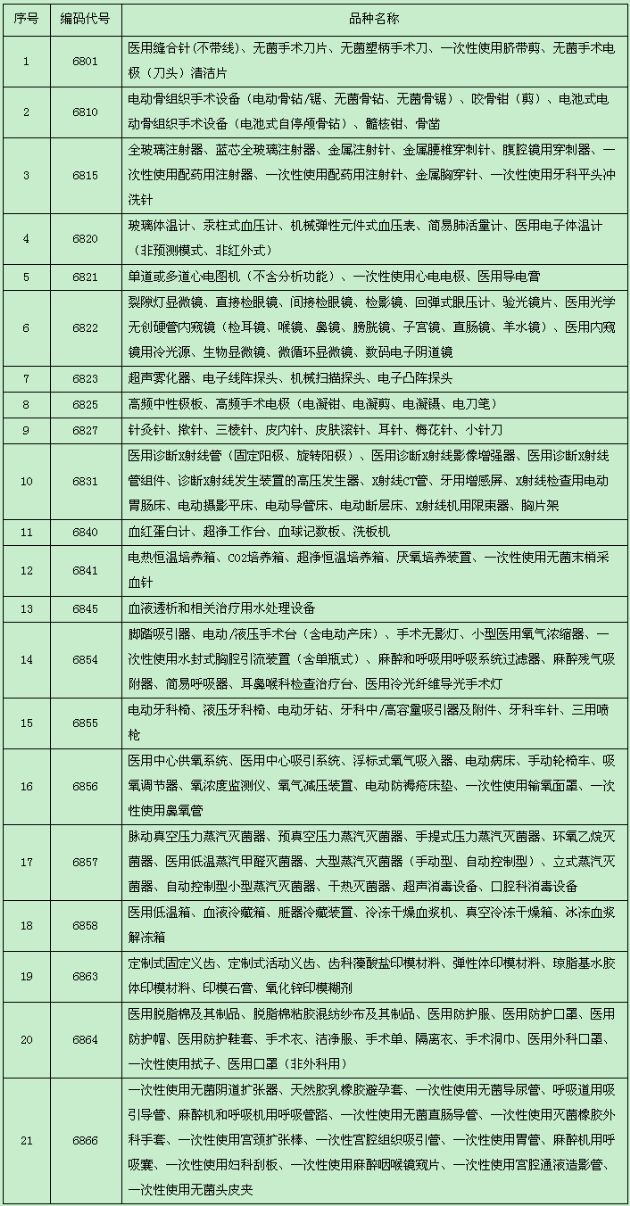
关于印发豁免提交临床试验资料的第二类医疗器械目录(试行)的通知国食药监械[2011]475号
各省、自治区、直辖市食品药品监督管理局(药品监督管理局):
为进一步加强医疗器械注册管理,严格规范第二类医疗器械注册申报资料要求,在总结各地实践经验的基础上,国家食品药品监督管理局组织制定了《豁免提交临床试验资料的第二类医疗器械目录(试行)》(见附件),现予印发,并就有关事宜通知如下:
一、医疗器械生产企业在申报本目录范围内产品注册时,可以书面申请免于提交临床试验资料,但应同时提交申报产品与已上市同类产品的对比说明。对比说明应当包括工作原理、产品材质、结构组成、主要技术性能指标、消毒/灭菌方法(如有)、预期用途、是否家庭使用等内容。
二、根据《医疗器械注册管理办法》附件12的规定,虽未列入本目录,但执行国家标准、行业标准的检验、诊断类第二类医疗器械,申报产品注册时,不需要提供临床试验资料。
三、本目录自发布之日起实施。地方各级食品药品监管部门要严格管理,不得擅自扩大目录范围。本目录发布前已受理的注册申报项目,按原规定继续审评、审批。
国家食品药品监督管理局
二一一年十一月二十四日
豁免提交临床试验资料的第二类医疗器械目录(试行)