- 2022-07-20 10:11
- 作者:佚名
- 来源:医疗器械经销商联盟
近日,北京市医保局发布了《关于印发CHS-DRG付费新药新技术除外支付管理办法的通知(试行)》(以下简称通知)。
通知提出了一项DRG除外支付办法,明确创新药、创新医疗器械、创新医疗服务项目可以不按DRG方式支付,单独据实支付。
DRG付费改革,是近年除带量采购、国家医保谈判之外,又一个医保控费的核心手段,此次政策首次提出创新器械、药品等能够豁免控费手段,无疑将大大鼓励医药行业创新的积极性。
全国首创
创新器械豁免DRG,开始单独支付
据通知要求, 符合要求的创新药/创新医疗器械,其创新性主要需要满足两点:
1.三年内(指含申报年及之前的两个自然年)经药监部门批准上市的新通用名药品/医疗器械;三年内因增加功能主治或适应症发生重大变化的药品;三年内新纳入国家医保药品目录的药品;三年内由于价格调整新增的可另行收费的医疗器械。
2.临床效果较传统药品/医疗器械有较大提升。
与此同时,申报的创新药/医疗器械,需要全市累计基本医疗保险参保人员病例达到50例以上,罕见病不受例数限制。
确认产品符合,即可由企业向北京市医疗保险事务管理中心申报即可。
CHS-DRG付费除外医疗器械申请表:

政策全文
京医保中心发〔2022〕30号
各有关定点医疗机构,各有关企业:
为进一步完善我市疾病诊断相关分组(CHS-DRG)付费工作,在发挥CHS-DRG引导规范医疗行为作用的同时,激发新药新技术创新动力。经研究,决定试行CHS-DRG付费新药新技术除外支付管理办法。现将有关问题通知如下:
一、申报范围
(一)药品及医疗器械申报范围
同时满足以下条件的药品及医疗器械由企业向北京市医疗保险事务管理中心(以下简称“市医保中心”)申报。
1.三年内(指含申报年及之前的两个自然年,下同)经药监部门批准上市的新通用名药品/医疗器械;三年内因增加功能主治或适应症发生重大变化的药品;三年内新纳入国家医保药品目录的药品;三年内由于价格调整新增的可另行收费的医疗器械。
2.取得国家医疗保障局医保药品分类与代码/医保医用耗材分类与代码。
3.符合相关价格政策规定。
4.临床效果较传统药品/医疗器械有较大提升。
5.对DRG病组支付标准有较大影响。
6.全市累计基本医疗保险参保人员病例达到50例以上,罕见病不受例数限制。
(二)诊疗项目申报范围
同时满足以下条件的诊疗项目由定点医疗机构向市医保中心申报。
1.公立定点医疗机构三年内在本市批准设立的新增医疗服务价格项目,具体包含医疗保障部门已转归统一定价的项目,以及按照《关于进一步完善本市新增医疗服务项目价格管理工作的通知(暂行)》(京医保发〔2022〕5号)要求履行了价格备案程序的项目;非公立定点医疗机构三年内在本市新增医疗服务价格项目。
2.取得国家医疗保障局医疗服务项目分类与代码。
3.在操作途径、操作方法、解剖部位、适用范围等方面有技术创新。
4.临床效果较传统诊疗项目有较大提升。
5.对DRG病组支付标准有较大影响。
6.申报定点医疗机构累计本市基本医疗保险参保人员病例达到15例以上,罕见病不受病例数量限制。
7.非公立定点医疗机构还需提供新增医疗服务价格项目具体开展时间的说明及佐证材料。
二、申报材料
(一)药品及医疗器械申报材料
1.CHS-DRG付费新药新技术除外支付申报书(见附件)。
2.批件材料。药品需提供药监部门审批通过的药品注册批件及说明书的扫描件;医疗器械需提供说明书及药监部门审批通过的医疗器械注册证及相关变更附件的扫描件。
3.临床创新性材料。对临床有效性或创新性进行详细描述,需包括但不限于与替代药品/医疗器械的对比分析材料及相关文献资料等。
4.运行分析报告。对三年内我市使用情况、已开展定点医疗机构、两年内的预期使用量及预计开展定点医疗机构等情况进行描述。
5.根据实际情况要求企业提供的其他材料。
6.上述材料及扫描件均需加盖企业公章。
(二)诊疗项目申报材料
1.CHS-DRG付费新药新技术除外支付申报书(见附件)。
2.临床创新性材料。对临床有效性或创新性进行详细描述,需包括但不限于与替代项目的对比分析材料及相关文献资料等。
3.根据实际情况要求定点医疗机构提供的其他材料。
4.上述材料及扫描件均需加盖定点医疗机构公章。
三、工作程序
(一)接收申报。申报具体时间另行通知,各有关企业和定点医疗机构按照申报要求和时限报送。
(二)形式审查。市医保中心收到各有关企业及定点医疗机构申报资料后,将对其完整性、真实性、合理性进行审查,并以邮件形式反馈形式审查结果。
(三)组织论证。包含专家论证和数据验证两个部分,其中专家论证是组织相关专业临床专家对申报的药品、医疗器械及诊疗项目的临床效果、创新性、应用合理性进行充分评估。数据验证是根据提交的病例及费用信息对申报的药品、医疗器械及诊疗项目对医保基金的影响进行统计分析。最终依据专家论证和数据验证的结果确定本市CHS-DRG付费新药新技术除外支付的药品、医疗器械及诊疗项目范围(以下简称“除外范围”)。
(四)公布结果。除外范围将在北京市医疗保障局官网(http://ybj.beijing.gov.cn/)公布。
(五)费用结算。除外范围内的药品、医疗器械及诊疗项目在未来三年(指含获批除外支付年度及之后的两个自然年)有效。市医保中心每年年终依据使用情况统一据实结算。
四、工作要求
(一)各有关定点医疗机构要进一步提高对我市CHS-DRG付费新药新技术除外支付工作的认识,以保障参保人员基本医疗需求为出发点,合理使用新药新技术,在推动临床发展的同时,加强医疗质量管理,规范临床诊疗行为。
(二)各有关企业及定点医疗机构申报新药新技术除外支付时要严格按照工作流程申报,并按要求提交相关资料,确保申报材料完整、真实、准确。未在规定时限内提交材料的,视为自动放弃。
(三)各有关企业及定点医疗机构要充分评估申报的药品、医疗器械或诊疗项目是否符合条件,申报通过率过低的,酌情暂停该企业或定点医疗机构的申报资格;除外范围公布后,一经发现因提供虚假资料造成基金损失的,立即追回相关费用,并依照有关规定予以严肃处理。
北京市医疗保险事务管理中心
2022年7月10日
原文链接:http://ybj.beijing.gov.cn/swdt/2020_tzgg/202207/t20220713_2771059.htm
众所周知,DRGs 属于医保的总包控费,在这种情况下,很容易导致临床上不敢使用临床效果更好但价额更贵的创新药品、器械,进而导致“劣币驱逐良币”的情况,而此次政策直接解决了这一问题。
虽然目前仅以北京市为试点执行,但后续有望在全国推进,进一步鼓励我国医药领域的研究与创新。
政策大放开,利好所有厂家、经销商
近年来,为鼓励医疗器械创新,激励产业高质量发展,2018年国家药监局修订发布《创新医疗器械特别审查程序》;2021年6月1日起施行的《医疗器械监督管理条例》也提出对创新医疗器械予以优先审评审批。
但从过去几年的政策来看,多以医保控费、降价为主,这给创新医疗器械以及企业带来了较大的市场压力。
对于企业来说,此次政策放开后,一方面有利于直接让创新医疗器械获得更合理的收益,加速放量;同时,进一步体现出我国医保“鼓励创新”的宗旨(过去更多是控费),并且未来政策导向和政策趋势可能会更为清晰。
另外,对于医疗器械经销商而言,被政策豁免的创新医疗器械,也将成为经销商翻身的重要机会。
据国家药监局通报,目前已有超过383个产品进入创新医疗器械绿色通道,166个创新性强、技术含量高、临床价值显著的产品上市。仅2022年上半年,就有55家企业的65件产品进入创新医疗器械特别审批通道,其中36件产品进入国家级创新审批通道,29件产品进入省级创新审批通道。
显然,一旦创新器械获批完成,预示着庞大的市场需求和市场空缺,在新政策加持下,经销商把握创新医疗器械是个不错的选择。
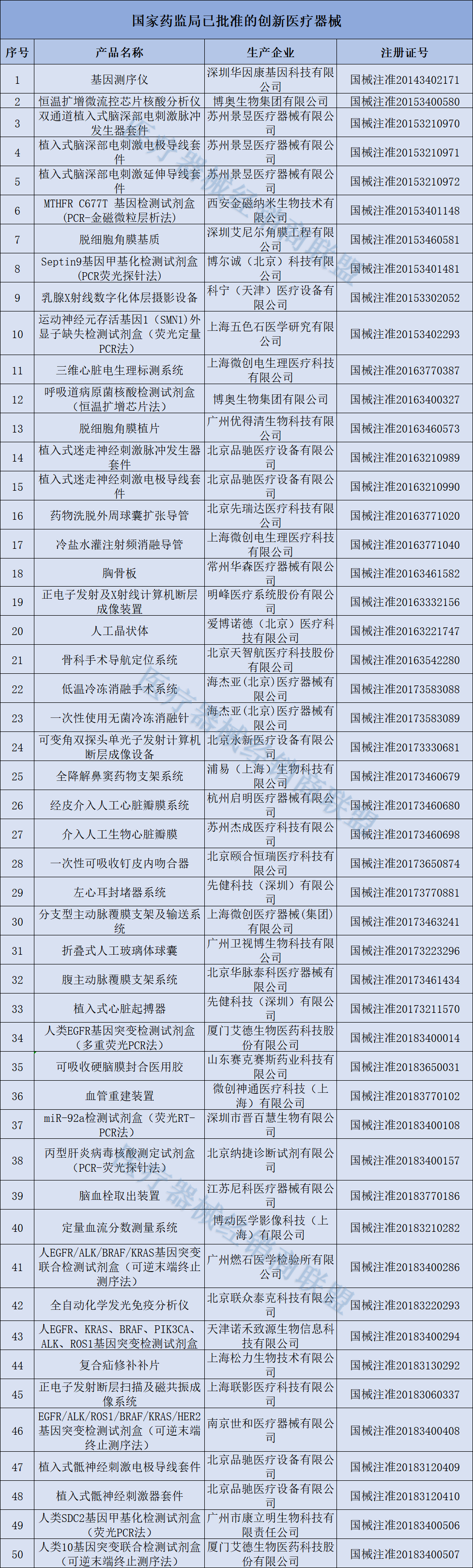
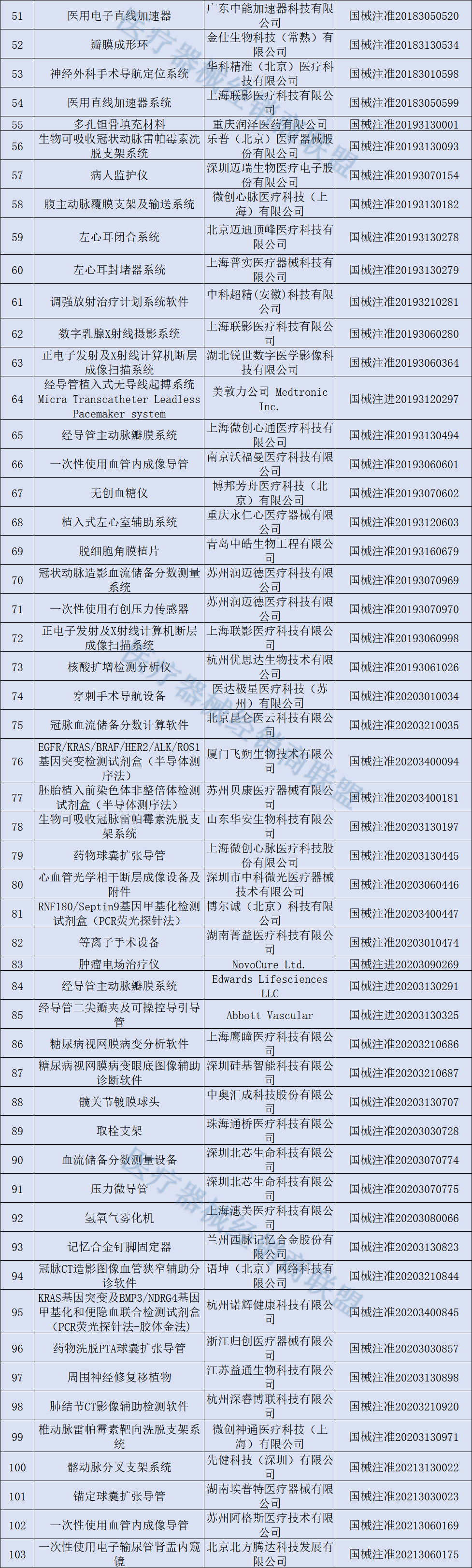
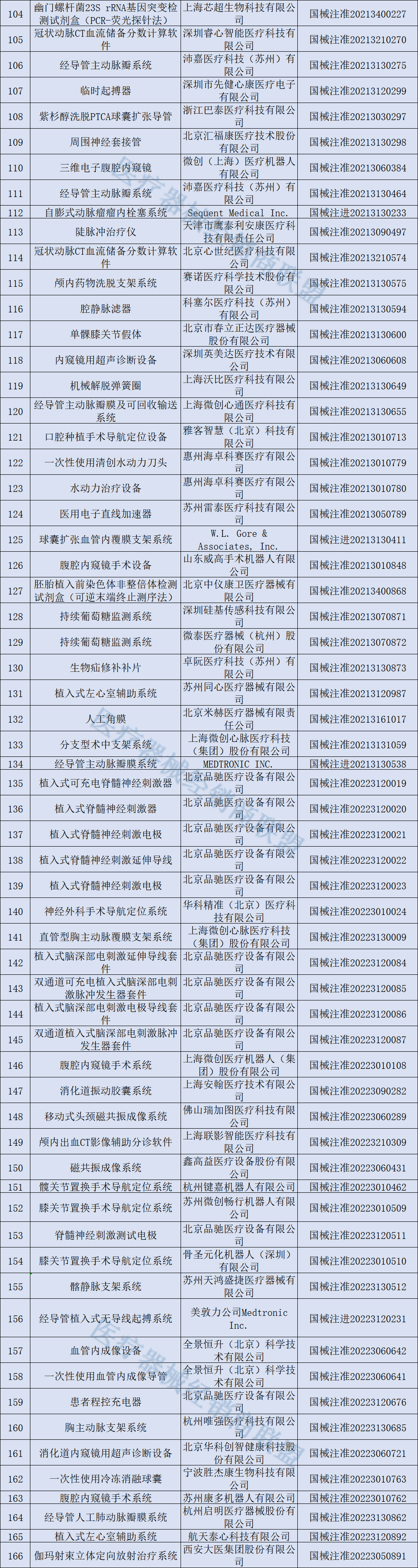
166种创新医疗器械获批
联影、美敦力、微创...
当然,率先获利的必然是已获批的创新医疗器械。
就在近几日,国家药监局刚刚批准了3款国产创新产品的注册申请,分别是西安大医集团股份有限公司生产的“伽玛射束立体定向放射治疗系统”、杭州启明医疗器械股份有限公司生产的“经导管人工肺动脉瓣膜系统”,以及航天泰心科技有限公司生产的“植入式左心室辅助系统”。
截至目前,已获批的166款创新医疗器械中,包括多款手术机器人、支架系统,以及可兼容3.0T MRI的脑起搏器、体外诊断试剂...美敦力、联影、微创等公司均有多个产品获批。
具体清单如下:
- 分享到:



