- 2017-12-20 10:50
- 作者:佚名
- 来源:医谷
12月20日,美国FDA宣布批准Spark Therapeutics的创新基因疗法Luxturna(voretigene neparvovec-rzyl)上市,用于治疗双等位基因RPE65突变导致的遗传性视网膜病变(IRD)的儿童和成人患者,值得一提的是,Luxturna也是首款在美国获批、靶向特定基因突变的“直接给药型”基因疗法,此前,Luxturna已经获得了美国FDA颁发的优先审评资格和突破性疗法认定。
据了解,IRD(遗传性视网膜疾病)是一种由220多种不同基因之一就可引起的一系列罕见致盲病症,双等位基因RPE65突变的IRD患者会由于儿童期或早期成年期的光敏感性降低以及不自主的前后眼球震颤运动,经常会出现夜盲症,随着疾病的进展,患者的视网膜感光细胞(色素细胞)会逐渐失去功能并坏死,最终导致视觉功能的完全丧失,大多数发病于儿童或者青少年,目前,还没有任何有效的医疗方案和获得批准的药物来治疗该疾病,不过,Luxturna的出现,则为这一疾病的患者带来了治愈的希望。
Luxturna由美国Spark Therapeutics医药公司研发,属于真正的基因药,有望能一次性治愈罕见遗传性儿童致盲病症,Luxturna利用腺相关病毒技术,能将健康的RPE65基因直接引入到视网膜细胞中,使之表达,这样具有正常功能的视网膜感光细胞就可能存活,因此患者也有望恢复视觉感知。
在先前的一项III期临床试验中,Luxturna已经取得了良好的结果,20名测试者中的18名患者在接受治疗一年之后,在迷宫测试中都取得了更好的成绩,其中13人通过了正常人最低视力水平的测试,超过一半的受实验者能够看清视力表上三行甚至更多行的字符,并且,试验中也未发生严重不良事件以及严重免疫事件。
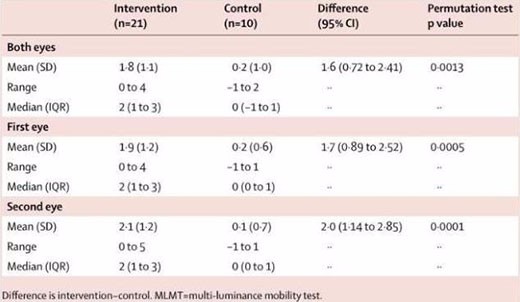
治疗组和对照组患者在1年间的MLMT分数变化(图片来源The Lancet)
不过,对于Luxturna的获批上市,有行业人士表示,其将在定价及报销模式上面临挑战,因为美国目前尚无可以借鉴的先例,而其它地方相关经验也不多。迄今为止,在欧盟上市的首个基因疗法,即 UniQure/Chiesi 用于治疗脂蛋白脂酶缺乏(LPLD)的 Glybera(alipogene tiparvovec)因缺少需求而被撤市,其每次治疗的费用高达100万欧元,葛兰素史克也将推出其基因疗法 Strimvelis,用于治疗腺苷脱氨酶缺乏性重度联合免疫缺陷症(ADA-SCID),不过该公司尚无计划讨论其疗法的定价。
- 分享到:



